父性遺伝する肥満の論文が公開されました。
父性遺伝する食事性肥満
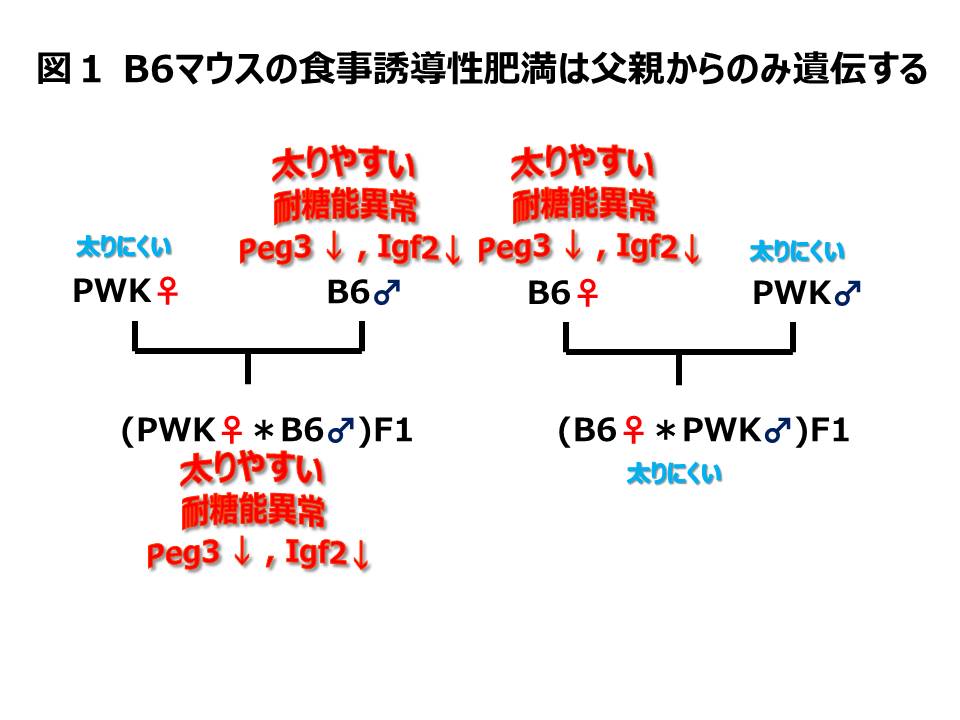
食事誘導性肥満は父性遺伝する
C57BL/6 (B6)マウスは高脂肪食を食べさせることにより肥満になりやすいが、その遺伝的背景についてはわかっていない。今回の研究では食事誘導性肥満になりやすいB6と食事誘導導性の肥満になりにくいPWKを交互に交配して2種類のF1をつくり肥満とインプリンティングの関係について調べた。B6が父親のとき、すなわち(PWK×B6) F1は食事誘導性肥満になりやすく耐糖能異常を示すが、PWKが父親のときは、すなわち(B6×PWK) F1では肥満にもなりにくく耐糖能異常も示さなかった(図1)。つまり食事誘導性肥満、耐糖能異常は父性遺伝することがわかった。
遺伝子発現が由来する親が父であるか母であるかにより発現が異なる現象をインプリンティングいう。父性インプリント遺伝子は父親由来のアレルのみ発現し、母性インプリント遺伝子は母親由来のアレルのみ発現する。これらの遺伝子の中には肥満や脂肪の分化に関係しているものも多く知られている。そこで父性遺伝する食事誘導性肥満がインプリント遺伝子の発現と関係していると考え、B6とPWKの白色脂肪におけるインプリント遺伝子の発現を調べた。その結果、父性発現遺伝子のPeg3と Igf2の発現が高脂肪食を食べさせることによりB6でのみ発現が減少していた(図1)。さらに興味深いことにF1の白色脂肪で発現を調べたところB6が父親のとき、すなわち(PWK×B6) F1はPeg3とIgf2の発現が高脂肪食を食べさせることにより減少するが、PWKが父親のとき、すなわち(B6×PWK) F1はPeg3とIgf2の発現が減少しなかった(図1)。すなわち食事誘導性肥満の父性遺伝に伴ってインプリント遺伝子の発現が変化することがわかった。
さて、これらの遺伝子の発現減少が肥満に関係するかであるが、Peg3はノックアウトすると体脂肪量が増加することが報告されている。Igf2はIGFシグナルを制御する遺伝子であり、その発現の減少が脂肪量の増加と関係することがマウスで報告されており、ヒトで血中のIGF2が少ないと肥満のリスクが増すという報告がある。またヒトのIGF2の多型と肥満との関連性についてのいくつかの報告がある。
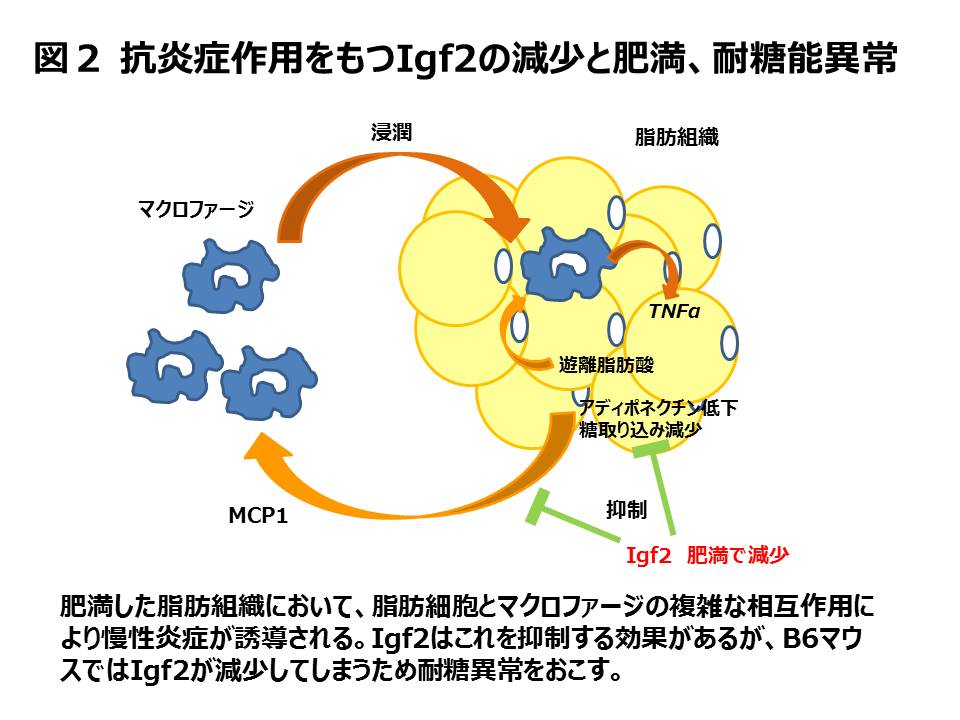
Igf2はTNF-aによる炎症作用から白色脂肪を守っている
近年、肥満は白色脂肪の慢性炎症と密接に関連していることがわかってきた(図2)。脂肪組織へのマクロファージの集積は体重の増加、脂肪の炎症、インスリン感受性の低下と関連している。肥満したマウスの白色脂肪では炎症性ケモカインであるMCP-1の分泌が増え、マクロファージが遊走してきて、炎症性のサイトカインであるTNF-aの分泌を促進する。それにより脂肪細胞の炎症は増悪し脂肪のインスリン感受性の低下がもたらされる。さらにMCP-1の分泌が増えるとともに、インスリン感受性を良くするアディポネクチンの分泌が減少する。
我々はIgf2が脂肪細胞にどのような影響を与えるかを白色脂肪細胞のモデルである3T3-L1細胞で調べた。その結果Igf2の添加によりTNF-aによるMCP-1の発現増加、アディポネクチンやグルコーストランスポーターであるGlut4の発現減少を抑えることができた。さらにIgf2はTNF-aによるインスリン依存的な糖取り込みの減少も抑えることができた。以上のことからIgf2はその抗炎症作用により肥満を抑制していることが示唆された(図2)。
結論
B6マウスの高脂肪食による食事誘導性の肥満と耐糖能異常は父性遺伝し、それはインプリント遺伝子のPeg3とIgf2の発現が白色脂肪で減少することと関係していた。このことはPeg3とIgf2が肥満と糖代謝を改善することを示唆する。また実際に3T3-L1脂肪細胞を使った実験でIgf2は抗炎症作用を持ち、糖代謝を改善していた。